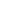瑞波西利高纯度杂质对照品:药物安全的"守护者"
发表时间:2025-09-01瑞波西利
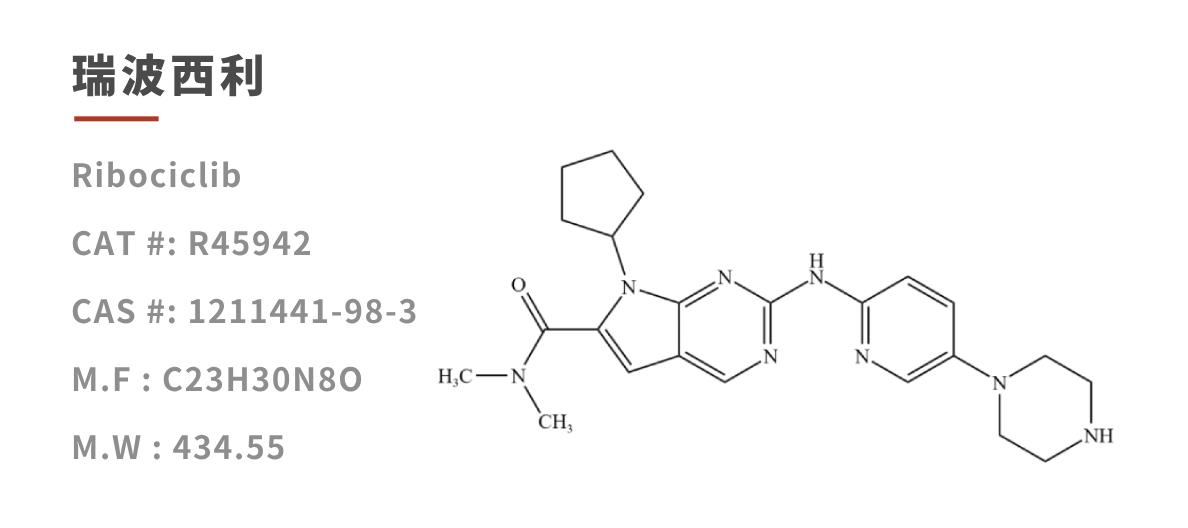
瑞波西利(Ribociclib,Kisqali)是国内首个在HR+/HER2-晚期乳腺癌一线治疗领域覆盖绝经前/围绝经期、绝经后人群的CDK4/6抑制剂,以其卓越的疗效和安全性,成为HR+/HER2-晚期乳腺癌患者的重要治疗选择,目前已被NCCN临床实践指南纳入乳腺癌一线用药方案。随着临床的广泛应用,进一步深入研究或可为后续药物开发提供新的突破口。
01
瑞波西利的市场及专利情况
瑞波西利(Ribociclib,Kisqali)自2017年3月13日经FDA首次获批上市以来,已在全球超过95个国家和地区获批使用,其销售额呈现持续增长态势,2023年及2024年销售额分别为20.8亿美元和30.33亿美元,随着适应症的拓展,其销售额更是不断攀升,2025年上半年收入 21.33 亿美元,同比增长约60%。
(以上瑞波西利内容介绍来源于网络,仅供参考)
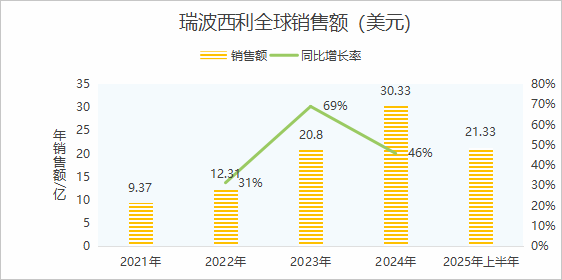
在专利保护方面,瑞波西利核心化合物专利将于2029年8月到期,药物组合专利保护期至2034年8月。
目前,受专利诉讼限制,短期内瑞波西利仿制药上市有限,但行业研发热度持续攀升——不仅CDK4/6领域头部药企积极布局,近年来相关API结晶、制剂等关键技术路径的专利申报也如雨后春笋般涌现,预示着该品种未来可观的市场潜力与多元开发机遇。
02
瑞波西利杂质研究的重要性
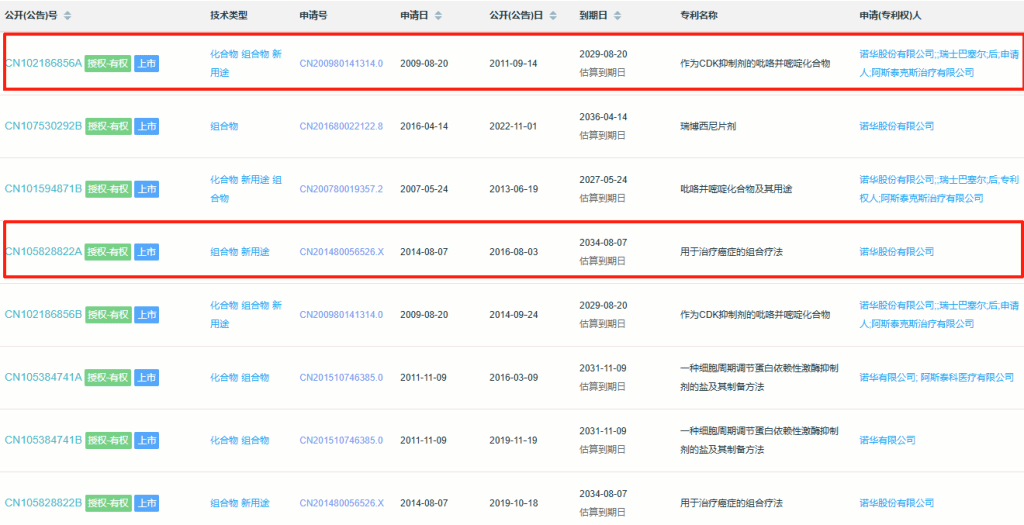
瑞波西利作为重要的抗癌药物,其杂质控制直接关系到临床用药的安全性、有效性和合规性,其重要性主要体现在以下方面:
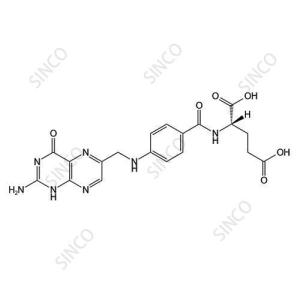
1、安全性保障:如瑞波西利N-氧化物可能影响药物代谢稳定性,需通过稳定性试验评估其增长趋势;合成过程中可能产生的溴代副产物(如4-bromopyridin-2-yl)和亚硝胺类杂质均需进行专项评估;
2、质量控制核心:瑞波西利的合成涉及多步催化反应如Suzuki偶联、哌嗪环修饰等,可能出现相关工艺杂质(如N-Demethyl-ribociclib),需精准监控。
3、法规合规性要求:药品申报需符合FDA、EMA和ICH指导原则,申报材料必须包含完整的杂质谱分析报告,杂质对照品是申报材料的必备支撑;
杂质研究是药品研发申报的核心环节,高纯度的杂质对照品及完整合规的杂质谱报告,是成功通过注册审评、降低发补风险、加速上市进程的基石。
03
Sinco——助力您的药物研发与生产
Sinco专注于为制药企业、CRO/CDMO机构及科研单位提供杂质研究服务,我们严格按照FDA、EMA等国际标准,提供高纯度、可溯源的对照品,助力您的药品研发与生产。
其他优势项目杂质供应:
阿贝西利、奥匹卡朋、贝凡洛尔、达格列净、达拉非尼、达普司他、地喹氯铵、伏诺拉生、非奈利酮、复瑞替尼、加兰他敏、氯噻酮、美洛加巴林、莫匹罗星、匹美西林、普瑞巴林、普托马尼、乳果糖、瑞美吉泮、瑞司美替罗、沙丁胺醇、苏泽曲林、他达那非、替格拉生、替普瑞酮、图卡替尼、维生素K1、叶酸、伊鲁阿克、依卡倍特纳、依拉环素、依折麦布、扎维吉泮等项目相关杂质。
更多杂质相关信息请访问:www.sincopharmachem.com